Insuffisance rénale et maladies cardiovasculaires
L’insuffisance rénale est très fréquemment observée chez le patient qui présente une maladie cardiovasculaire (MCV). À l’inverse, le patient insuffisant rénal a comme principale cause de décès une maladie coronarienne [1].
En 2006, une analyse de 16 études combinées a révélé que parmi une cohorte de 80 098 patients insuffisants cardiaques, 29% présentaient un Débit de Filtration Glomérulaire (DFG) inférieur à 53 ml/min et que 63% présentaient un DFG inférieur à 90 ml/min [2]. Ces interactions cœur–reins constituent le socle physiopathologique à l’origine du syndrome cardio-rénal (SCR).
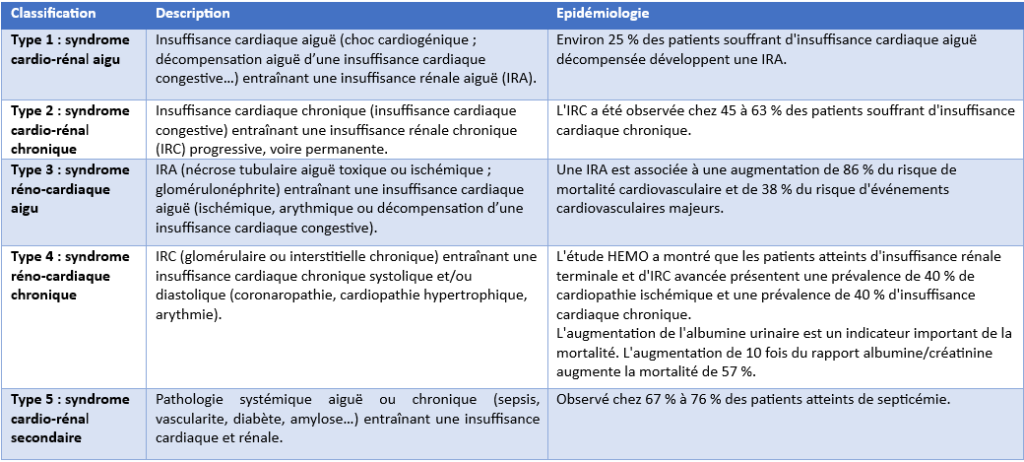
Le syndrome cardio-rénal est défini comme : « une entité physiopathologique complexe touchant le cœur et les reins dans laquelle la dysfonction aiguë ou chronique d’un des organes peut induire une dysfonction aiguë ou chronique de l’autre organe » [3]. Cinq sous-types du SCR ont été décrits [3-5] :
Les mécanismes qui déterminent le SCR sont multifactoriels et complexes.
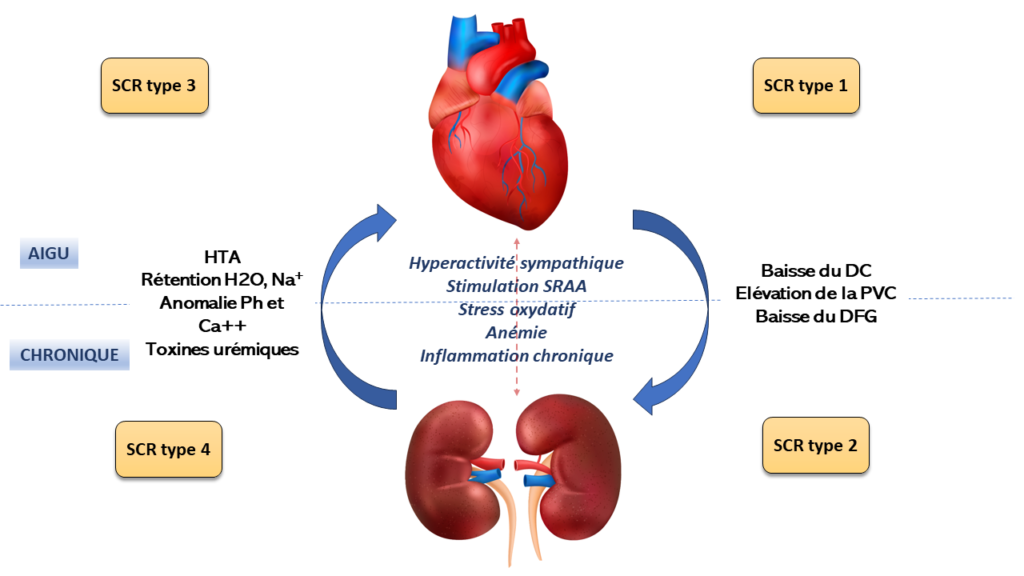
Figure 1 : Résumé des mécanismes physiopathologiques des différents syndromes cardio-rénaux (SCR). HTA : hypertension artérielle ; SRAA : système rénine–angiotensine–aldostérone ; DC : débit cardiaque ; PVC : pression veineuse centrale ; DFG : débit de filtration glomérulaire [3]
La forte prévalence des MCV est liée aux facteurs de risque cardiovasculaires classiques et aux facteurs de risque spécifiques à l’IRC, dits non classiques :
Les facteurs de risque cardiovasculaires classiques sont l’âge, le diabète, le tabagisme, et l’hypertension artérielle (HTA). Ces différents facteurs impliqués dans la genèse de l’IRC sont des causes majeures de MCV. L’IRC peut elle-même entrainer l’émergence ou l’aggravation de ces facteurs de risque cardiovasculaires comme la dyslipidémie, l’hyperhomocystéinémie et l’HTA [1].
L’HTA est un facteur de risque majeur dans l’IRC, dont elle est à la fois une cause et une conséquence. Sa prévalence augmente avec la sévérité de l’IRC. Plusieurs mécanismes contribuent à l’élévation de la pression artérielle dans l’IRC : la rétention hydrosodée, l’activation du système rénine-angiotensine essentiellement, d’autres facteurs comme l’hyperactivité du système sympathique, le défaut de production du NO et l’hyperparathyroïdie.
L’HTA constitue, avec l’anémie, le principal mécanisme en cause dans l’hypertrophie ventriculaire gauche du patient insuffisant rénal, qui, du fait d’une demande accrue en oxygène, prédispose à l’apparition d’une cardiopathie ischémique. L’HTA est également responsable d’artériopathies et contribue au développement de la plaque d’athérosclérose. L’ensemble de ces mécanismes contribuent à la genèse de la pathologie coronarienne [1].
Les facteurs de risque non classiques incluent la surcharge hydrosodée, l’altération du métabolisme phosphocalcique et l’anémie. Il a été montré que l’anémie seule, dans cette population, augmentait le risque relatif de survenue d’événements cardiovasculaires par 1,5. L’anémie induirait une hypertrophie ventriculaire gauche (HVG). L’association de l’HVG et de l’anémie augmente le risque relatif de survenue d’événements cardiovasculaires par 4 [1].
L’hémodialyse constitue également un facteur de risque non classique. Les troubles électrolytiques, l’hypoperfusion et les variations rapides des concentrations en électrolytes intracellulaires et extracellulaires pendant l’hémodialyse, en particulier les fluctuations des taux de potassium, de magnésium et de calcium, pourraient contribuer à l’allongement de l’intervalle QT [6].
L’allongement de l’intervalle QT (>460 ms chez les ♀ et >450 ms chez les ♂) est associé à un risque accru de torsade de pointes, de mort cardiaque subite et de mortalité toutes causes confondues dans la population générale. En effet, le risque d’allongement de l’intervalle QT est 1,20 fois, 2,47 fois et 3,35 fois plus élevé chez les patients atteints d’insuffisance rénale de stade 4, stade 5 et hémodialysés, respectivement, que chez les patients atteints d’insuffisance rénale de stade 3. L’accumulation de médicaments prolongeant l’intervalle QT peut entrainer une majoration du risque de survenue de troubles du rythme [6].
La maîtrise des mécanismes sous-jacents responsables des SCR revêt une importance cruciale dans leur gestion. Cela implique la prise en compte du traitement de la cause, qu’elle soit d’origine cardiaque ou rénale, ainsi que la prise en charge des répercussions de cette défaillance sur le cœur ou les reins, avec une orientation idéalement préventive.
Références :
- S. Charriere, N. Rognant, F. Chiche, A. Cremer, G. Deray, M. Priou. Annales de Cardiologie et d’Angéiologie 58 (2009) 40–52 Revue de la littérature. Insuffisance rénale chronique et maladie cardiovasculaire Chronic renal insufficiency and cardiovascular disease
- Grace L Smith, Judith H Lichtman, Michael B Bracken, Michael G Shlipak, Christopher O Phillips, Paul DiCapua, Harlan M Krumholz. J Am Coll Cardiol. 2006 May 16;47(10):1987-96. Renal impairment and outcomes in heart failure: systematic review and meta-analysis
- S. Goursaud · D. du Cheyron. Réanimation (2014) 23:585-594. Le syndrome cardiorénal : diagnostic, physiopathologie et prise en charge
- Rupesh Raina, Nikhil Nair, Ronith Chakraborty, Lena Nemer, Rahul Dasgupta, Kenneth Varian. Cardiol Res. 2020 Apr;11(2):76-88. An Update on the Pathophysiology and Treatment of Cardiorenal Syndrome
- Claudio Ronco, Luca Di Lullo. Kidney Dis (Basel). 2017 Jan;2(4):151-163. Cardiorenal Syndrome in Western Countries: Epidemiology, Diagnosis and Management Approaches
- Peng Liu, Lu Wang, Dan Han, Chaofeng Sun, Xiaolin Xue, Guoliang Li. Ren Fail. 2020 Nov;42(1):54-65. Acquired long QT syndrome in chronic kidney disease patients
Rédigé le 06/11/2023 par Aicha Mbarek
Docteur en Pharmacie, GPR
Suivez-nous sur LinkedIn
















