Dépistage Déficit en DPD : Recommandation ANSM, HAS et INCa
L’ANSM recommande un dépistage systématique du déficit en DPD avant toute administration de 5-FU ou Capécitabine.
Mise à jour le 28/07/2023
Le déficit en dihydropyrimidine déshydrogénase (DPD) est associé à un risque de toxicités graves, potentiellement létales, associées aux chimiothérapies à base de fluoropyrimidines (5-fluorouracile, 5-FU, et capécitabine). Le GPCO-UNICANCER et le RNPGx ont publié le 24 février dernier une mise au point sur cette question dans laquelle leur recommandation est de « rechercher un déficit en DPD avant la mise en route de tout traitement à base de 5-FU ou de capécitabine, en priorité chez les patients à risque élevé de toxicité (administration de 5-FU en bolus ou à fortes doses, femmes traitées par la capécitabine, toxicité aux fluoropyrimidines rapportée chez un membre de la famille, comorbidités ou fragilité particulière) ainsi qu’en situation de traitement adjuvant ». [lien vers l’article dans le Bulletin du Cancer]
L’Agence Nationale de Sécurité du Médicament (ANSM) s’appuie sur ce travail pour préconiser « le dépistage du déficit en dihydropyrimidine deshydrogénase (DPD), conformément aux recommandations du Groupe de Pharmacologie Clinique Oncologique (GPCO) – Unicancer et le Réseau National de Pharmacogénétique Hospitalière portant sur ce dépistage et sur la sécurisation des chimiothérapies à base de fluoropyrimidines qui ont été actualisées en février 2018 ».
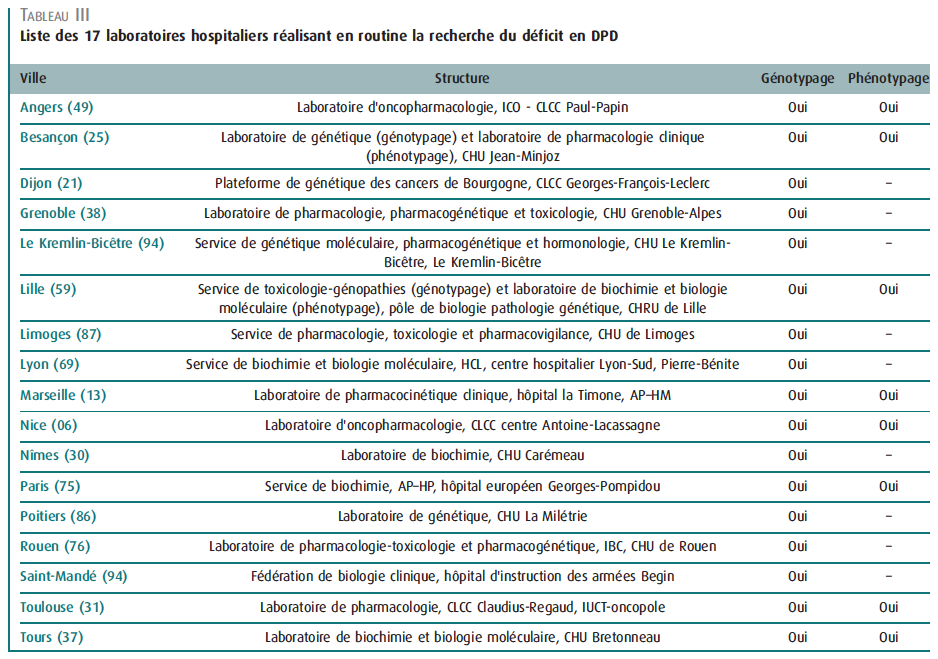
Dans le cadre du Bon Usage Clinique des fluoropyrimidines (5-fluorouracile, 5-FU, et capécitabine), il semble indispensable de procéder à ce dépistage systématiquement. Dans leur article, le GPCO-UNICANCER et le RNPGx listent les 17 laboratoires réalisant ces tests en routine sur le territoire français. En l’absence de test, il semble médicalement nécessaire d’envisager une alternative thérapeutique.
MISE À JOUR DU 21 DÉCEMBRE 2018 : « L’Institut national du cancer (INCa) et la Haute Autorité de Santé (HAS) publient des recommandations sur les modalités de recherche du déficit en enzyme DPD dans le cadre de chimiothérapies comportant des fluoropyrimidines. L’objectif est d’éviter certaines toxicités très graves chez des patients déficitaires en enzyme DPD, enzyme qui contribue à l’élimination par l’organisme de ces médicaments. En février 2018, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a préconisé la recherche d’un déficit en DPD pour tout patient concerné par une chimiothérapie intégrant des fluoropyrimidines. Pour détecter en pratique ce déficit, l’INCa et la HAS recommandent aujourd’hui la réalisation d’un examen : la mesure de l’uracilémie. »
MISE À JOUR DU 30 AVRIL 2019 :
MISE À JOUR DU 13 septembre 2021 :
Les modalités de prescription, de dispensation et d’utilisation de ces médicaments en France restent inchangées suite à cette décision européenne.
Concernant les médicaments à base de 5-FU (voie parentérale) capecitabine et tegafur :
- Le dépistage du déficit en DPD est recommandé avant l’initiation de ces traitements. En France, l’obtention du résultat du dépistage d’un déficit en DPD par la mesure de l’uracilémie (phénotypage) est nécessaire avant l’initiation d’un traitement par fluoropyrimidines et conditionne la prescription et la délivrance.
- Leur utilisation est contre-indiquée chez les patients présentant un déficit complet en DPD.
- Chez les patients avec un déficit partiel en DPD, une dose initiale réduite doit être envisagée.
Concernant les médicaments à base de 5-FU (voie parentérale) :
- Un suivi thérapeutique pharmacologique (STP) du 5-FU peut améliorer les résultats cliniques chez les patients recevant des perfusions continues de 5-FU.
Concernant les médicaments à base de flucytosine (une prodrogue de 5-fluorouracile utilisé pour les infections fongiques systémique) :
- L’initiation du traitement ne doit pas être retardée, et un test préalable du déficit en DPD n’est pas recommandé.
- En cas de survenue d’une toxicité sévère, un arrêt du traitement par flucytosine doit être envisagé
Concernant les modalités de réalisation du test de dépistage du déficit en DPD :
La mesure de l’uracilémie (phénotypage) et la détection des variants du gène DPYD (génotypage) sont deux méthodes acceptées dans l’Union Européenne.
En France, pour les spécialités à base de 5-FU (voie parentérale) et de capécitabine, la prescription et la délivrance sont subordonnées à l’obtention du résultat du dépistage d’un déficit en DPD par la mesure de l’uracilémie.
Le prescripteur mentionne sur la prescription « résultats uracilémie pris en compte », et le pharmacien vérifie cette mention lors de la dispensation.
En France, les recommandations de l’INCA/HAS datées du 18 décembre 2018[1] restent applicables.
Ces recommandations ne s’appliquent pas aux produits à base de 5-FU et utilisés par voie cutanée.
Les substances actives concernées en France sont 5-fluorouracile (5-FU), capécitabine et flucytosine. A ce jour, aucune spécialité à base de tegafur n’est commercialisée en France. Vous trouverez un tableau des spécialités et laboratoires concernés avec les contacts utiles pour les spécialités à base de 5-FU et capécitabine.
MISE À JOUR DU 5 novembre 2024 :
L’ANSM informe :
- Chez les patients présentant une insuffisance rénale modérée ou sévère, les taux sanguins d’uracile utilisés pour le test de dépistage par phénotypage d’un déficit en dihydropyrimidine déshydrogénase (DPD) doivent être interprétés avec prudence.
- Une altération de la fonction rénale est susceptible d’entraîner une augmentation des taux sanguins d’uracile.
- Par conséquent, il existe un risque accru de diagnostic erroné du déficit en DPD, ce qui peut entraîner un sous-dosage en 5-FU et conduire à une réduction de l’efficacité du traitement.
Article connexe :
Référence :
Suivez nous sur LinkedIn