Docteur Michaël Thy, Service de Médecine Intensive – Réanimation médicale, Hôpital Bichat – Claude-Bernard, 15 mars 2024.
1) Sepsis chez l’enfant
L’infection bactérienne chez l’enfant admis en réanimation est source de morbi-mortalité (1). Son traitement efficace est possible sous réserve d’administrer les antibiotiques rapidement et de manière appropriée. Outre le délai et l’adaptation de la molécule au site d’infection et au spectre du germe suspecté ou identifié, la posologie de l’antibiotique doit être optimale pour atteindre rapidement et durablement une concentration efficace (2,3). Le sepsis en réanimation pédiatrique peut être associé ou compliqué d’une insuffisance rénale aigue (IRA) ce qui aggrave son pronostic (4,5). L’élimination rénale étant le mode d’élimination principale de la plupart des β-lactamines et des antibiotiques, une IRA peut générer un risque d’accumulation et donc de surdosage.
2) Insuffisance rénale aigue et épuration extra-rénale
L’IRA est une diminution du débit de filtration glomérulaire (DFG) définie par différentes classifications : notamment p-RIFLE (pediatric Risk, Injury, Failure, Loss of kidney function, and End-stage renal failure) et AKIN (Acute Kidney Injury Network) qui évalue la sévérité en fonction de la créatininémie et de la diurèse résiduelle (6–8). La fonction rénale peut être estimée selon différentes méthodes, la plus courante étant le calcul du DFG utilisant, comme marqueur, la créatininémie en conditions stables (Schwartz (10), Cockcroft, MDRD, CKD-EPI) ou portant sur l’excrétion urinaire de la créatinine sur un temps donné, (Formule : créatininurie des 24h x Volume urinaire des 24h / créatininémie). D’autres biomarqueurs existent comme la cystatine C ou le NGAL urinaire qui peuvent permettre d’estimer le DFG mais également de prédire la survenue d’IRA sévères (11,12).
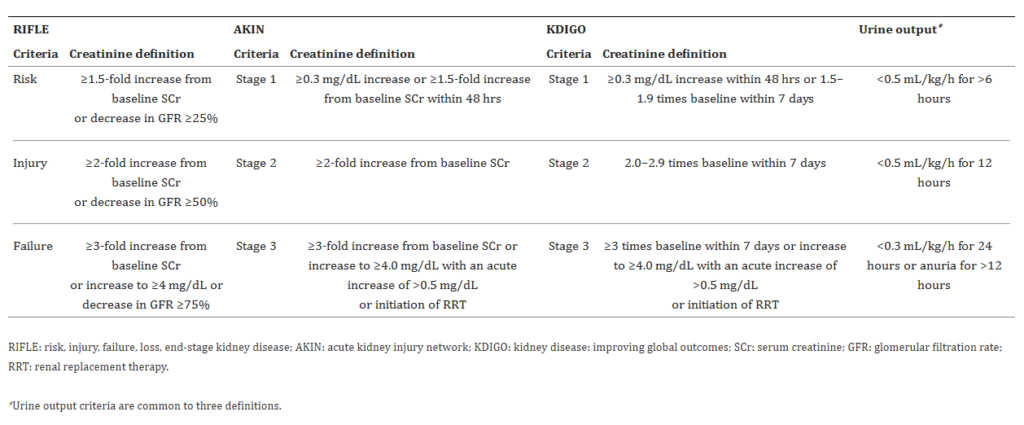
Tableau 1 : Comparatif des classifications d’IRA selon RIFLE, AKIN et KDIGO,
(9, 51)
Le pRIFLE diffère du RIFLE par l’absence de critère spécifique sur la créatininémie.
L’IRA atteint environ un tiers des patients admis en réanimation pédiatrique, elle est associée à un risque élevé de morbi-mortalité (1-3). En cas de défaillance rénale sévère (ex : KDIGO stade 3), il peut être nécessaire d’avoir recours à une épuration extra-rénale (EER).
Les modalités d’élimination des médicaments par l’EER dépendent de plusieurs facteurs : (i) les propriétés du médicament : poids moléculaire, liaison aux protéines ; (ii) les modalités d’épuration continue ou discontinue : dialyse, filtration et leurs débits respectifs, taille et composition des filtres utilisés (15). La variabilité inter-individuelle mais également intra-individuelle complique la prédiction de l’élimination, rendant ainsi aléatoire l’adaptation des posologies du traitement antibiotique (16). L’épuration extra-rénale continue veino-veineuse (EERC) est l’une des techniques d’EER les plus utilisées chez l’enfant (17). En raison de son utilisation continue, l’EERC est généralement mieux tolérée par les enfants en réanimation (18,19). Le recours à l’EERC est principalement initié dans un contexte de défaillance multiviscérale associé à une mortalité plus importante (20,21).
3) Pharmacocinétique en contexte critique et d’EER
L’exposition optimale aux antibiotiques est primordiale dans cette population vulnérable d’enfants en soins critiques sous EER. Cela implique de déterminer, dès le début du traitement, une posologie adaptée pour chaque patient. Le choix de cette posologie doit s’adapter à l’impact du contexte critique et, de l’EER sur la pharmacocinétique (PK) des antibiotiques en tenant compte de :
La variabilité inter-individuelle
Dans la population d’enfants en soins critiques sous EER, celle-ci peut se décliner en 3 niveaux :
- La variabilité liée à la maturation des organes jusqu’à l’âge de 2 ans puis à leur croissance influence les capacités de métabolisme et d’élimination (22,23).
Concernant la distribution, une fois que la répartition des fluides dans l’organisme approche les valeurs adultes (vers 6 mois), l’évolution du secteur hydrique est proportionnelle au poids.
- La variabilité liée aux états critiques et au sepsis. L’inflammation associée au sepsis induit des modifications hémodynamiques et tissulaires aboutissant à des variations de débits régionaux et à l’apparition d’œdèmes interstitiels et d’hypoalbuminémie. La gravité de la maladie infectieuse (défaillances d’organes, altération de la liaison aux protéines plasmatiques et répartition des fluides) est également impliquée (25,26). Il est ainsi, souvent, observé une augmentation du volume de distribution et une modification de la clairance rénale des médicaments hydrophiles (27,28).
Les posologies utilisées chez l’enfant, sont rapportées au poids et sont le plus souvent une extrapolation linéaire de données établies chez les adultes ou les enfants non hospitalisés en réanimation (26,29), faisant ainsi l’hypothèse d’une différence proportionnelle : le poids. Si la variabilité des paramètres PK est bien liée au poids, cette relation n’est pas linéaire. Une étude américaine suggère, par ailleurs, qu’avec les posologies actuellement recommandées en pédiatrie, 95 % des patients en réanimation pédiatrique n’atteignent pas la cible thérapeutique sans adaptation posologique (30). Cela motive, le plus souvent, une augmentation des posologies s’accompagnant d’un surrisque d’émergence de toxicité et de la nécessité d’un suivi thérapeutique pharmacologique (STP) plus rapproché.
- La variabilité liée à l’utilisation de circuits extracorporels (EER). Les changements PK liés à la gravité des patients sont amplifiés par l’utilisation de l’EER, notamment l’EERC (26). Ignorer les spécificités PK des patients en réanimations pédiatriques sous EER pourrait conduire à une exposition inappropriée et imprévisible aux anti-infectieux, et induire des risques d’échec thérapeutique, de toxicité ou d’émergence de résistances bactériennes. Contrairement aux adultes, peu de données existent concernant la posologie des antibiotiques chez les enfants sous EERC (31–33). Chez les enfants en réanimation recevant une EERC, de nombreux facteurs peuvent impacter la clairance du médicament, tels que : les propriétés physico-chimiques des médicaments (poids moléculaire, liaison aux protéines, volume de distribution (VD), les caractéristiques des patients (persistance de clairances résiduelles rénale ou hépatique), et les modalités/paramètres d’EER utilisés (taille et type de filtre avec un phénomène d’adsorption possible) (34), les débits sanguins, de dialysat ou d’ultrafiltration avec un impact variable possible de la diffusion et de la convection à travers le filtre (35).
Les médicaments hydrophiles de faible taille, ayant un faible VD et une grande fraction non liée (principalement concentrés dans le plasma), seront théoriquement éliminés plus facilement par EERC que les médicaments à VD plus important (35,36). En effet, la faible taille des pores des membranes du filtre limite la diffusion ou la convection à la fraction non liée des médicaments et aux médicaments de bas poids moléculaire (17). La clairance obtenue par EERC peut également être augmentée dans les cas d’hypoprotidémie associée, souvent liée à la gravité de l’état du patient, par l’augmentation de la fraction libre du médicament. Outre l’adaptation des posologies en fonction des propriétés du médicament, le clinicien pourrait adapter les posologies des médicaments aux modifications du débit sanguin ou du dialysat/ultrafiltration (34,37).
La variabilité intra-individuelle
Elle peut se décliner en trois niveaux :
-la variabilité de l’état critique et son évolutivité au cours du temps (débits régionaux de perfusion des organes, du poids, clairance résiduelle, etc.)
-la variabilité des paramètres de l’EER (type et débits prescrits) au cours du temps, l’âge du filtre, etc.
-la variabilité liée à l’administration de médicaments : la voie d’administration et la posologie, les co-médications, etc.
La variabilité pharmacodynamique
La variabilité des caractéristiques des germes en cause (sensibilité et résistance aux antibiotiques, notamment la concentration minimale inhibitrice (CMI)), la variabilité du mode d’action des antibiotiques (bactéricide ou bactériostatique), la variabilité de l’inoculum selon les individus (quantité de bactéries et diffusion au site infecté) et selon le temps (diminution de l’inoculum ou migration), devrait impacter le rapport PK/PD.
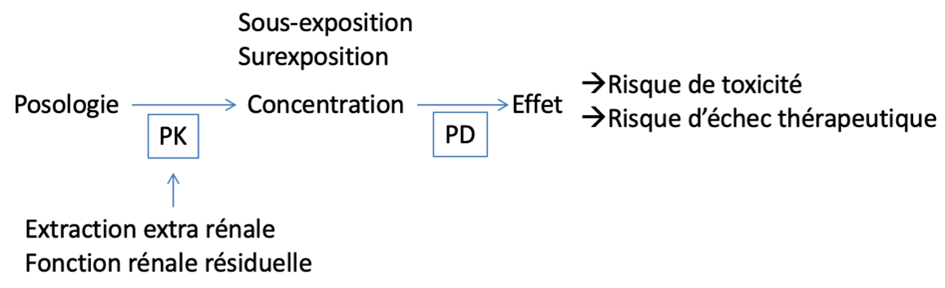
Figure 1 : Schéma simplifié de pharmacocinétique et pharmacodynamie des antibiotiques
Le risque d’une exposition non optimale aux antibiotiques est élevé. Les posologies actuellement utilisées sont le plus souvent empiriques et ne tiennent pas compte de la grande variabilité inter et intra-individuelle, ni des paramètres PK spécifiques à l’enfant en soins critiques sous EERC (3,38).
4) Pratiques de prescription des anti-infectieux sous EERC
Devant de tels facteurs de variabilité, une enquête multicentrique a été publiée et réalisée auprès des réanimateurs pédiatriques francophones grâce au Groupe Francophone de Réanimation et d’Urgences Pédiatriques (GFRUP). Cette enquête avait pour objectif de décrire les pratiques de prescription d’anti-infectieux chez les enfants sous EERC afin de mettre en évidence les difficultés et les obstacles liés à l’ajustement de posologie des anti-infectieux.
L’enquête comportait trois sections descriptives :
- caractéristiques de la réanimation pédiatrique,
- pratiques d’EERC (hémofiltration veino-veineuse continue (CVVH), hémodialyse veino-veineuse continue (CVVHD) ou hémodiafiltration veino-veineuse continue (CVVHDF)) ou hémodialyse intermittente (HDI) ou dialyse péritonéale (DP) (les échanges plasmatiques et les techniques d’adsorption étaient exclues) et la gestion de la prescription d’EERC (débit sanguin, débit de dialysat, débits d’ultrafiltration),
- stratégies d’ajustement pour optimiser le dosage et l’utilisation du suivi thérapeutique pharmacologique (STP) pour la pratique quotidienne.
Il était également demandé aux participants s’ils ajustaient a priori les doses d’anti-infectieux à l’EERC. Cela comprenait l’ajustement de la dose (augmentation ou diminution de la dose par injection) et/ou la modification du débit de perfusion (augmentation ou diminution du nombre de doses par jour, augmentation de la durée de la perfusion, y compris la perfusion continue sur 24 heures). Lors de l’ajustement de la posologie anti-infectieuse, il a été demandé aux participants s’ils basaient leur ajustement sur : 1) les paramètres PK (poids moléculaire, fraction liée aux protéines, propriété hydrophile ou lipophile, voies naturelles d’élimination et diurèse résiduelle) et/ou 2) les paramètres de l’EERC notamment la modalité d’EERC : CVVH, CVVHD ou CVVHDF et les débits d’ultrafiltration/réinjection, de dialysat ou de diafiltration, respectivement. Les sources et références utilisées par les praticiens pour ajuster la dose des anti-infectieux ont également été recueillies. Plusieurs suggestions ont été faites concernant les obstacles potentiels à l’utilisation du STP, notamment l’absence d’un laboratoire sur place, la complexité du processus de dosage, le retard dans l’obtention des résultats et le manque de conseils sur l’ajustement de la dose.
Cette enquête a mis en évidence que l’adaptation de posologie des anti-infectieux sous EER en pédiatrie est un problème actuel concret. Malgré un consensus concernant la nécessité d’ajuster la dose d’anti-infectieux au contexte d’EERC, il existe une grande variabilité inter-service et intra-service concernant les modalités d’ajustement de la dose d’anti-infectieux chez les enfants hospitalisés en réanimation pédiatrique et mis sous EERC. Cela témoigne d’une possible méconnaissance des données physico-chimiques de chaque anti-infectieux et également du manque de données convaincantes, compréhensibles, ou aisément accessibles pour l’adaptation de posologie sous EERC. En effet, toutes les réanimations pédiatriques et tous les médecins de cette enquête ont signalé un manque de ressources consensuelles, de recommandations, de leur implémentation et d’éducation. L’hétérogénéité des réponses concernait également les modalités d’EERC, ce qui reste cohérent avec les résultats d’une précédente étude évaluant la gestion de l’EERC dans les réanimations pédiatriques (41).
En France, les répondants ont déclaré utiliser VIDAL® pour consulter les RCP et l’outil d’adaptation posologique à la fonction rénale GPR© (42,43). Les RCP recensent les informations des études de développement. En l’absence de consensus, les fiches GPR fournissent, des données concernant la dialysabilité des molécules, le poids moléculaire, le volume de distribution, la liaison aux protéines plasmatiques et leur variabilité en cas d’insuffisance rénale, et des données de littératures permettant d’établir ou d’orienter le choix posologique en cas d’EERC. Cependant, ces ressources sont encore imparfaites pour l’enfant en réanimation car elles sont basées sur des études et des recommandations établies pour les adultes (33).
Le manque de données et de recommandations pourrait être partiellement compensé par un STP accessible. Cependant, cette enquête a mis en évidence les obstacles liés à l’utilisation du STP. Améliorer l’accessibilité du STP pourrait donc également être utile pour obtenir des résultats et une adaptation des doses plus rapide.
Cette enquête souligne la nécessité d’améliorer les connaissances sur la PK des anti-infectieux lorsqu’ils sont utilisés chez les enfants en réanimation pédiatrique sous EERC ; d’améliorer les possibilités d’utilisation du STP ; et de développer des approches de modélisation PK et de simulations de posologies individualisées basées sur des modèles.
5) Mise à jour des données sur l’adaptation de posologie des anti-infectieux sous EERC en pédiatrie
Des modèles mathématiques, basés sur les caractéristiques physicochimiques de l’antibiotique, les caractéristiques des patients, le suivi des concentrations circulantes de médicament et les spécificités de l’EER, peuvent permettre d’améliorer l’ajustement des posologies de l’antibiothérapie en l’absence de dosages sériques.
La modélisation PK et PD consiste à utiliser des équations mathématiques pour décrire la réponse d’un système à une administration de médicament. Son objectif est d’estimer les paramètres moyens PK/PD et leur variabilité afin de prédire l’exposition à un médicament dans l’organisme en fonction des modalités d’administration et des caractéristiques individuelles des patients.
Bien que le STP puisse permettre un ajustement a posteriori en fonction des concentrations de médicament observées et des résultats microbiologiques (44–46), son intérêt peut être limité en raison de la nécessité d’attendre l’atteinte de l’état d’’équilibre, du délai de rendu des résultats engendrant une adaptation qui ne se fait qu’a posteriori de l’introduction de l’antibiothérapie. Cela diffère de l’ajustement bayésien, une méthode d’ajustement tenant compte a priori de l’information connue des effets fixes et aléatoires, des paramètres de la population, de la variabilité résiduelle, de la valeur des covariables des différents sujets (47). Des études pharmacologiques spécifiques comme les études PK utilisant la modélisation de l’approche populationnelle (PKPOP) peuvent ainsi être utiles pour optimiser d’emblée le schéma posologique pour chaque patient (48).
A titre d’illustration, deux récentes études ont décrit des modèles PKPOP pour le méropénem (49) et la pipéracilline (50) chez les enfants en réanimation pédiatrique subissant une EERC. Ces deux études ont mis en évidence la variabilité élevée entre les sujets et décrivent l’impact de l’allométrie, du débit d’effluent et de la fonction rénale résiduelle (diurèse résiduelle) sur les paramètres PK.
Il semble nécessaire d’administrer le méropénèm en perfusion continue, en particulier avec un débit d’effluent élevéet une concentration minimale inhibitrice (CMI) élevée. A contrario, des doses intermittentes quotidiennes à posologies plus réduites (12h) semblent suffisantes pour obtenir une exposition adéquate lorsque le débit d’effluent est faible.
Chez les enfants sous EERC avec diurèse résiduelle, l’exposition optimale à la pipéracilline a été atteinte avec des perfusions continues à doses croissantes, fonction de la CMI et du poids. Chez les patients anuriques, il a été observé un risque d’accumulation nécessitant d’espacer les doses intermittentes après une dose de charge initiale. D’autres études sont nécessaires pour optimiser ces différents modèles afin d’aider le clinicien à optimiser les posologies d’antibiotiques en tenant compte des caractéristiques du patient et des paramètres de l’EERC.
Références :
1. Schlapbach LJ, Straney L, Alexander J, MacLaren G, Festa M, Schibler A, et al. Mortality related to invasive infections, sepsis, and septic shock in critically ill children in Australia and New Zealand, 2002–13: a multicentre retrospective cohort study. The Lancet Infectious Diseases. janv 2015;15(1):46‑54.
2. Chiotos K, Gerber JS, Himebauch AS. How can we optimize antibiotic use in the pediatric intensive care unit? Pediatr Crit Care Med. sept 2017;18(9):903‑4.
3. Downes KJ, Hahn A, Wiles J, Courter JD, Vinks AA. Dose optimisation of antibiotics in children: application of pharmacokinetics/pharmacodynamics in paediatrics. International Journal of Antimicrobial Agents. mars 2014;43(3):223‑30.
4. Weiss SL, Fitzgerald JC, Pappachan J, Wheeler D, Jaramillo-Bustamante JC, Salloo A, et al. Global epidemiology of pediatric severe sepsis: the sepsis prevalence, outcomes, and therapies study. Am J Respir Crit Care Med. 15 mai 2015;191(10):1147‑57.
5. Xiao C, Wang S, Fang F, Xu F, Xiao S, Li B, et al. Epidemiology of Pediatric Severe Sepsis in Main PICU Centers in Southwest China. Pediatr Crit Care Med. 1 juill 2019;
6. Khwaja A. KDIGO Clinical Practice Guidelines for Acute Kidney Injury. Nephron Clinical Practice. 7 août 2012;120(4):c179‑84.
7. Luo X, Jiang L, Du B, Wen Y, Wang M, Xi X, et al. A comparison of different diagnostic criteria of acute kidney injury in critically ill patients. Crit Care. 8 juill 2014;18(4):R144.
8. Lameire NH, Levin A, Kellum JA, Cheung M, Jadoul M, Winkelmayer WC, et al. Harmonizing acute and chronic kidney disease definition and classification: report of a Kidney Disease: Improving Global Outcomes (KDIGO) Consensus Conference. Kidney Int. sept 2021;100(3):516‑26.
9. Sutherland SM, Byrnes JJ, Kothari M, Longhurst CA, Dutta S, Garcia P, et al. AKI in hospitalized children: comparing the pRIFLE, AKIN, and KDIGO definitions. Clin J Am Soc Nephrol. 7 avr 2015;10(4):554‑61.
10. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. A simple estimate of glomerular filtration rate in children derived from body length and plasma creatinine. Pediatrics. août 1976;58(2):259‑63.
11. Filler G, Bhayana V, Schott C, Díaz-González de Ferris ME. How should we assess renal function in neonates and infants? Acta Paediatr. mars 2021;110(3):773‑80.
12. Meena J, Thomas CC, Kumar J, Mathew G, Bagga A. Biomarkers for prediction of acute kidney injury in pediatric patients: a systematic review and meta-analysis of diagnostic test accuracy studies. Pediatr Nephrol. oct 2023;38(10):3241‑51.
13. Kari JA, Alhasan KA, Shalaby MA, Khathlan N, Safdar OY, Al Rezgan SA, et al. Outcome of pediatric acute kidney injury: a multicenter prospective cohort study. Pediatr Nephrol. 2018;33(2):335‑40.
14. Shalaby M, Khathlan N, Safder O, Fadel F, Farag YMK, Singh AK, et al. Outcome of acute kidney injury in pediatric patients admitted to the intensive care unit. Clin Nephrol. déc 2014;82(6):379‑86.
15. Arzuaga A, Isla A, Gascón AR, Maynar J, Corral E, Pedraz JL. Elimination of Piperacillin and Tazobactam by Renal Replacement Therapies with AN69 and Polysulfone Hemofilters: Evaluation of the Sieving Coefficient. Blood Purification. 2006;24(4):347‑54.
16. Gotta V, Marsenic O, Pfister M. Understanding the Effects of Kidney Disease and Dialysis Treatment on Pharmacotherapy in Children. Handb Exp Pharmacol. 15 juin 2019;
17. Beltramo F, DiCarlo J, Gruber JB, Taylor T, Totapally BR. Renal Replacement Therapy Modalities in Critically Ill Children. Pediatr Crit Care Med. 2019 Jan;20(1):e1-e9.
18. Goldstein SL. Advances in Pediatric Renal Replacement Therapy for Acute Kidney Injury: ADVANCES IN PEDIATRIC RENAL REPLACEMENT THERAPY. Seminars in Dialysis. mars 2011;24(2):187‑91.
19. Bridges BC, Askenazi DJ, Smith J, Goldstein SL. Pediatric Renal Replacement Therapy in the Intensive Care Unit. Blood Purification. 2012;34(2):138‑48.
20. Pedersen O, Jepsen SB, Toft P. Continuous renal replacement therapy for critically ill infants and children. Dan Med J. 2012 Feb;59(2):A4385.
21. Yetimakman AF, Kesici S, Tanyildiz M, Bayrakci US, Bayrakci B. A Report of 7-Year Experience on Pediatric Continuous Renal Replacement Therapy. J Intensive Care Med. 1 janv 2017;885066617724339.
22. Choi G, Gomersall CD, Tian Q, Joynt GM, Li AMMY, Lipman J. Principles of antibacterial dosing in continuous renal replacement therapy. Blood Purif. 2010;30(3):195‑212.
23. Lu H, Rosenbaum S. Developmental Pharmacokinetics in Pediatric Populations. 2014;19(4):15.
24. Anderson BJ, Holford NHG. Mechanism-based concepts of size and maturity in pharmacokinetics. Annu Rev Pharmacol Toxicol. 2008;48:303‑32.
25. Roberts DM, Roberts JA, Roberts MS, Liu X, Nair P, Cole L, et al. Variability of antibiotic concentrations in critically ill patients receiving continuous renal replacement therapy: a multicentre pharmacokinetic study. Crit Care Med. mai 2012;40(5):1523‑8.
26. Thakkar N, Salerno S, Hornik CP, Gonzalez D. Clinical Pharmacology Studies in Critically Ill Children. Pharmaceutical Research. janv 2017;34(1):7‑24.
27. De Waele JJ, Lipman J, Akova M, Bassetti M, Dimopoulos G, Kaukonen M, et al. Risk factors for target non-attainment during empirical treatment with β-lactam antibiotics in critically ill patients. Intensive Care Med. sept 2014;40(9):1340‑51.
28. Roberts JA, Aziz MHA, Lipman J, Mouton JW, Vinks AA, Felton TW, et al. Challenges and Potential Solutions – Individualised Antibiotic Dosing at the Bedside for Critically Ill Patients: a structured review. Lancet Infect Dis. juin 2014;14(6):498‑509.
29. Udy AA, Roberts JA, Lipman J. Clinical implications of antibiotic pharmacokinetic principles in the critically ill. Intensive Care Medicine. déc 2013;39(12):2070‑82.
30. Cies JJ, Moore WS, Enache A, Chopra A. β-lactam Therapeutic Drug Management in the PICU. Crit Care Med. 2018;46(2):272‑9.
31. Li L, Li X, Xia Y, Chu Y, Zhong H, Li J, et al. Recommendation of Antimicrobial Dosing Optimization During Continuous Renal Replacement Therapy. Frontiers in Pharmacology. 2020;11:786.
32. Pistolesi V, Morabito S, Di Mario F, Regolisti G, Cantarelli C, Fiaccadori E. A Guide to Understanding Antimicrobial Drug Dosing in Critically Ill Patients on Renal Replacement Therapy. Antimicrob Agents Chemother. 20 mai 2019;63(8):e00583-19, /aac/63/8/AAC.00583-19.atom.
33. Stitt G, Dubinsky S, Edginton A, Huang YV, Zuppa AF, Watt K, Downes K. Antimicrobial Dosing Recommendations in Pediatric Continuous Renal Replacement Therapy: A Critical Appraisal of Current Evidence. Front Pediatr. 2022 May 12;10:889958.
34. Heintz BH, Matzke GR, Dager WE. Antimicrobial Dosing Concepts and Recommendations for Critically Ill Adult Patients Receiving Continuous Renal Replacement Therapy or Intermittent Hemodialysis. Pharmacotherapy. mai 2009;29(5):562‑77.
35. Awdishu L, Bouchard J. How to Optimize Drug Delivery in Renal Replacement Therapy: HOW TO OPTIMIZE DRUG DELIVERY IN RENAL REPLACEMENT THERAPY. Seminars in Dialysis. mars 2011;24(2):176‑82.
36. Wong WT, Choi G, Gomersall CD, Lipman J. To increase or decrease dosage of antimicrobials in septic patients during continuous renal replacement therapy: the eternal doubt. Current Opinion in Pharmacology. oct 2015;24:68‑78.
37. Böhler J, Donauer J, Keller F. Pharmacokinetic principles during continuous renal replacement therapy: Drugs and dosage. Kidney International. nov 1999;56:S24‑8.
38. Felton TW, Hope WW, Roberts JA. How severe is antibiotic pharmacokinetic variability in critically ill patients and what can be done about it? Diagnostic Microbiology and Infectious Disease. août 2014;79(4):441‑7.
39. Thy M, Naudin J, Genuini M, Leteurtre S, Recher M, Oualha M, et al. Anti-infective prescribing practices in critically ill children on continuous renal replacement therapy: a multicenter survey of French-speaking countries. J Nephrol. 12 sept 2023 .
40. Matusik E, Lemtiri J, Wabont G, Lambiotte F. Beta-lactam dosing during continuous renal replacement therapy: a survey of practices in french intensive care units. BMC Nephrol. 2022 Jan 29;23(1):48.
41. Daverio M, Cortina G, Jones A, Ricci Z, Demirkol D, Raymakers-Janssen P, et al. Continuous Kidney Replacement Therapy Practices in Pediatric Intensive Care Units Across Europe. JAMA Network Open. 15 déc 2022;5(12):e2246901.
42. VIDAL [Internet]. [cité 14 nov 2022]. VIDAL, L’intelligence médicale au service du soin. Disponible sur: https://www.vidal.fr/
43. Rein – adaptation posologique [Internet]. SiteGPR. [cité 27 août 2018]. Disponible sur: http://sitegpr.com/
44. EUCAST: Clinical breakpoints and dosing of antibiotics [Internet]. [cité 22 juin 2020]. Disponible sur: eucast: Clinical breakpoints and dosing of antibiotics
45. Westermann I, Gastine S, Müller C, Rudolph W, Peters F, Bloos F, et al. Population pharmacokinetics and probability of target attainment in patients with sepsis under renal replacement therapy receiving continuous infusion of meropenem: Sustained low-efficiency dialysis and continuous veno-venous haemodialysis. Br J Clin Pharmacol. 5 avr 2021;
46. Evans L, Rhodes A, Alhazzani W, Antonelli M, Coopersmith CM, French C, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021. Intensive Care Med. nov 2021;47(11):1181‑247.
47. Shaw AR, Mueller BA. Antibiotic Dosing in Continuous Renal Replacement Therapy. Adv Chronic Kidney Dis. 2017;24(4):219‑27.
48. Cohen J. Confronting the threat of multidrug-resistant Gram-negative bacteria in critically ill patients. J Antimicrob Chemother. mars 2013;68(3):490‑1.
49. Thy M, Urien S, Bouazza N, Foissac F, Gana I, Bille E, et al. Meropenem Population Pharmacokinetics and Dosing Regimen Optimization in Critically Ill Children Receiving Continuous Renal Replacement Therapy. Clin Pharmacokinet. nov 2022;61(11):1609‑21.
50. Thy M, Urien S, Foissac F, Bouazza N, Gana I, Bille E, et al. Piperacillin Population Pharmacokinetics and Dosing Regimen Optimization in Critically Ill Children Receiving Continuous Renal Replacement Therapy. Antimicrob Agents Chemother. 20 déc 2022;66(12):e0113522.
51. Shin SR, Kim WH, Kim DJ, Shin IW, Sohn JT. Prediction and Prevention of Acute Kidney Injury after Cardiac Surgery. Biomed Res Int. 2016;2016:2985148.

















