Hépatologie et insuffisance rénale
Comment fonction rénale et hépatique s’influencent-elles ?
Effets de l’insuffisance rénale chronique sur la fonction hépatique
L’insuffisance rénale chronique (IRC) peut avoir de multiples effets sur la fonction hépatique, en raison de l’interaction complexe entre ces deux organes. En cas de réduction de la capacité de filtration des reins, l’insuffisance rénale, l’excrétion des médicaments à élimination urinaire est réduite, mais également l’excrétion de substances (déchets) appelées toxines urémiques. Ces dernières vont s’accumuler dans la circulation, pénétrer dans les hépatocytes et interagir avec le métabolisme hépatique des médicaments éliminés par le foie [1].
Plusieurs études démontrent que les activités de diverses enzymes hépatiques et de transporteurs de médicaments sont réduites en cas d’IRC [3]. Malgré sa faible excrétion urinaire (8 % de la dose totale), le répaglinide, un médicament principalement métabolisé dans le foie après absorption par le polypeptide transporteur d’anions organiques (OATP), présentait une demi-vie terminale presque quatre fois plus longue, et une exposition (ASC) trois fois plus élevée chez les patients ayant une fonction rénale < 30 ml/min que chez les sujets ayant une fonction rénale normale [2].
Plusieurs mécanismes ont été avancés pour expliquer l’altération du métabolisme des médicaments en cas d’IRC, en particulier ceux des voies métaboliques médiées par le cytochrome (CYP). Les données disponibles proviennent, en grande partie, d’études expérimentales réalisées sur des modèles animaux. Les mécanismes incluent [4] :
- des altérations de la transcription des gènes et de la traduction des protéines,
- une réduction de l’activité et de l’expression des CYP due à l’inhibition de la biosynthèse des hémoprotéines et/ou à une dégradation accrue de l’enzyme,
- un épuisement des cofacteurs (par exemple, réserve de nicotinamide adénine dinucléotide phosphate (NADPH),
- une inhibition compétitive directe de l’enzyme CYP par les toxines urémiques circulantes.
Une étude des microsomes hépatiques humains a montré que les toxines urémiques peuvent aussi inhiber les isoformes UGT (1A1, 1A9), indiquant ainsi l’effet des maladies rénales chroniques sur les réactions de glucuronidation [3] (figure 1).
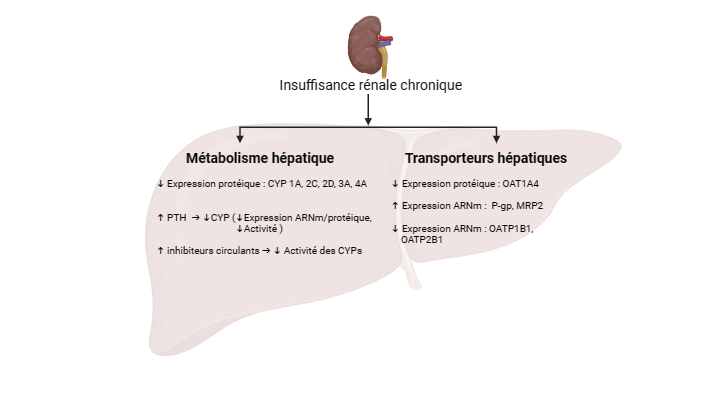
Figure générée à partir de BioRender.com
Syndrome hépatorénal
L’insuffisance rénale aigue (IRA) est l’une des complications les plus fréquentes de la cirrhose décompensée, avec une incidence de 20 à 50 % chez les patients cirrhotiques hospitalisés. Environ 20 % des patients atteints de cirrhose avancée développeront un syndrome hépatorénal (SHR) au cours de la première année suivant le diagnostic, et 40 % en développeront un au cours des 5 années suivantes [5,6].
Le SHR est déclenché par divers facteurs, notamment une infection bactérienne, une antibiothérapie, une hémorragie gastro-intestinale ainsi qu’un traitement diurétique. Il se définit comme une altération fonctionnelle réversible de la fonction rénale chez un patient atteint d’une cirrhose du foie avancée ou d’une insuffisance hépatique fulminante, sans atteinte histologique du rein et en l’absence d’autres causes potentielles d’IR. [6,7].
Il existe deux formes de SHR [6] :
- SHR de type 1: forme aiguë très rapidement évolutive dont le pronostic est très sévère ;
- SHR de type 2: forme chronique d’installation progressive et de meilleur pronostic que la forme aiguë.
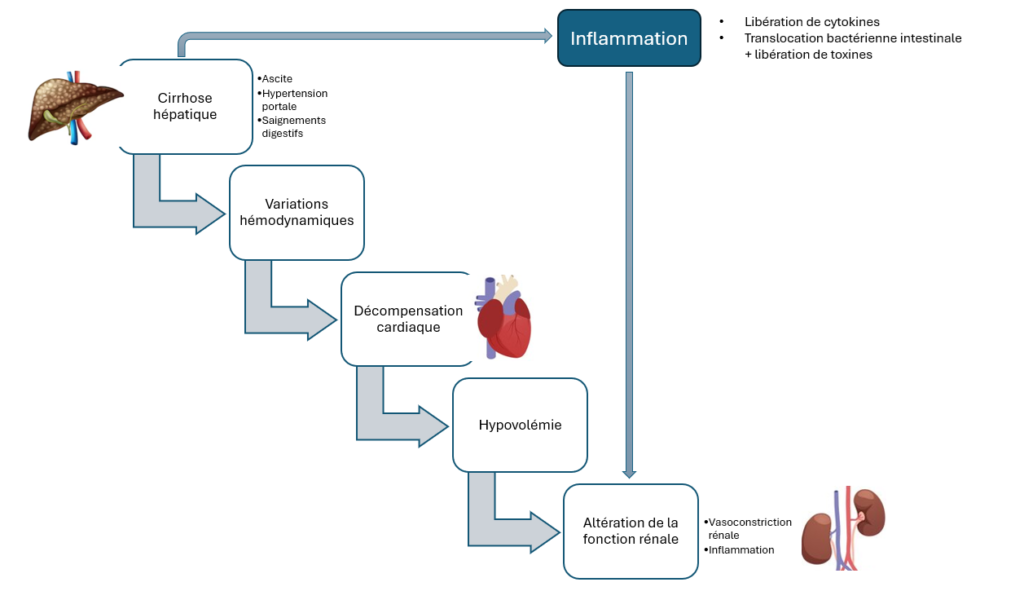
Le SHR résulte d’une interaction complexe entre différents événements hémodynamiques et inflammatoires.
Les événements hémodynamiques comprennent des événements vasculaires (vasodilatation splénique, vasoconstriction systémique, déséquilibre entre les substances vasodilatatrices et vasoconstrictrices, etc.), une dysfonction cardiaque, une défaillance de l’autorégulation rénale, un réflexe hépatorénal, une insuffisance surrénalienne, une hypertension portale, tandis que les événements inflammatoires incluent une réponse inflammatoire systémique [6-8] (figure 2).
Images freepik.com macrovector.
Le pronostic du SHR est sombre avec un taux de mortalité avoisinant les 90 %, trois mois après le diagnostic de la maladie. Bien que des options thérapeutiques soient disponibles, elles ne sont pas toujours efficaces pour restaurer la fonction rénale, mais elles peuvent prolonger la survie suffisamment longtemps pour permettre une transplantation hépatique [6].
Estimation de la fonction rénale en cas de cirrhose hépatique
La créatinine sérique sous-estime le déclin de la fonction rénale chez les patients atteints de cirrhose en raison de l’altération de la production hépatique de créatine (précurseur de la créatinine), de la réduction de la masse musculaire, de la sécrétion tubulaire de créatinine et de la mesure imprécise de la créatinine par des méthodes calorimétriques en présence d’une bilirubine sérique élevée. Le recours à la cystatine C dans les équations conventionnelles de DFG permettrait d’améliorer les performances diagnostiques [8,9].
Références
- Launay-Vacher V. Lettre ICAR, GPR. 13 décembre 2018. Adaptation posologique chez l’insuffisant rénal : Les médicaments métabolisés par le foie sont aussi concernés !
- Ming-Liang Tan, Kenta Yoshida, Ping Zhao, Lei Zhang, Thomas D Nolin, Micheline Piquette-Miller, Aleksandra Galetin, Shiew-Mei Huang. Clin Pharmacol Ther. 2018 May;103(5):854-867. Effect of Chronic Kidney Disease on Nonrenal Elimination Pathways: A Systematic Assessment of CYP1A2, CYP2C8, CYP2C9, CYP2C19, and OATP
- Roberto Padrini. Eur J Drug Metab Pharmacokinet. 2019 Feb;44(1):1-12. Clinical Pharmacokinetics and Pharmacodynamics of Direct Oral Anticoagulants in Patients with Renal Failure
- Catherine K Yeung, Danny D Shen, Kenneth E Thummel, Jonathan Himmelfarb. Kidney Int. 2014 Mar;85(3):522-8. Effects of chronic kidney disease and uremia on hepatic drug metabolism and transport
- Ojeda-Yuren AS, Cerda-Reyes E, Herrero-Maceda MR, Castro-Narro G, Piano S. An Integrated Review of the Hepatorenal Syndrome. Ann Hepatol. 2021 May-Jun;22:100236.
- Irtiza Hasan, Tasnuva Rashid, Razvan M Chirila, Peter Ghali, Hani M Wadei. Rom J Intern Med. 2021 Aug 26;59(3):227-261. Hepatorenal syndrome: pathophysiology and evidence-based management update
- F. Gonzalez, F. Vincent, Y. Cohen. Réanimation Volume 16, Issues 7–8, November–December 2007, Pages 605-611 Syndrome hépatorénal : prévention et traitement Hepatorenal syndrome: Prevention and treatment
- Douglas A Simonetto, Pere Gines, Patrick S Kamath. BMJ. 2020 Sep 14:370:m2687. Hepatorenal syndrome: pathophysiology, diagnosis, and management
- Mindikoglu AL, Dowling TC, Weir MR, Seliger SL, Christenson RH, Magder LS. Performance of chronic kidney disease epidemiology collaboration creatinine-cystatin C equation for estimating kidney function in cirrhosis. Hepatology. 2014 Apr;59(4):1532-42.
Rédigé par Dr Aicha Mbarek, GPR.
Mise à jour 30/04/2024
Suivez-nous sur LinkedIn
















