Docteur Maxime Coutrot 1,2
1Service d’Anesthésie, Réanimation et Centre de Traitement des Brûlés, Hôpital Saint-Louis, Paris, Ile-de-France, France
2UMR INSERM 942, Institut National de la Santé et de la Recherche Médicale (INSERM), Hôpital Lariboisière, Paris, Ile-de-France, France
Critères diagnostiques d’insuffisance rénale aiguë
L’insuffisance rénale aiguë (IRA) correspond à une baisse du débit de filtration glomérulaire (DFG) sur une période de 7 jours. Les critères diagnostiques de l’IRA, post-opératoire ou non, et de sa sévérité reposent encore actuellement sur la créatininémie (SCr) et la diurèse, selon la classification KDIGO (Kidney Disease : Improving Global Outcomes) 1,2 (Tableau 1)
Tableau 1- Classification de l’IRA selon les critères KDIGO
| Stade | Créatinine plasmatique | Diurèse |
| 1 | Augmentation de la SCr ≥ 26,5 μmol/l (≥ 0.3 mg/dL) en 48h ou 1,5 à 1,9 fois la créatinine plasmatique de base en 7 j | < 0,5 ml/kg/h pendant 6 h à 12h |
| 2 | 2,0 à 2,9 fois la créatinine plasmatique de base | < 0,5 ml/kg/h pendant ≥ 12h |
| 3 | 3,0 fois la créatinine plasmatique de base ou créatinine plasmatique ≥ 354 μmol/l (≥ 4,0 mg/dl) ou mise en route de l’épuration extra-rénale | < 0,3ml/kg/h pendant ≥ 24h ou anurie pendant ≥ 12h |
Le stade est déterminé par le critère le plus péjoratif entre « créatinine plasmatique » et « diurèse ».
Ces critères manquent cependant de sensibilité et de spécificité, notamment en contexte péri-opératoire.
L’augmentation de la créatininémie est tardive et traduit déjà une baisse importante du DFG. Cela justifie de considérer une augmentation faible de créatininémie comme une IRA (stade KDIGO 1). Par ailleurs, une expansion volémique importante peut entraîner une dilution de la créatininémie et masquer son augmentation en cas d’IRA.
D’autre part, une oligurie n’est pas synonyme d’IRA. Elle peut résulter d’une sécrétion accrue de l’hormone antidiurétique, sous l’influence de stimuli non osmotiques, fréquents en contexte péri-opératoire (douleurs, administration de morphiniques, nausées, vomissements, hypotension artérielle, hypovolémie). Une anurie ou une oligurie sévère (< 0.3 mL/kg/h) doivent cependant toujours être considérées comme pathologiques 3,4.
Pour pallier les défauts de la classification KDIGO, le calcul de la clairance de la créatinine est utile pour monitorer la fonction rénale en contexte péri-opératoire. Les formules de calcul de la clairance de la créatinine couramment utilisées (Cockroft & Gault, Chronic Kidney Disease – Epidemiology Collaboration – CKD-EPI) ne sont valables que pour l’insuffisance rénale chronique (IRC), où l’équilibration de la créatinine entre les différents compartiments est atteinte. Lors d’une IRA, notamment en période péri-opératoire, le DFG doit être estimé par le calcul de la clairance de la créatinine selon la formule « UV/P créatinine » (ou sur la période considérée : U= créatininurie, V= volume d’urine, et P= créatininémie) 5.
Physiopathologie et conséquences de l’IRA
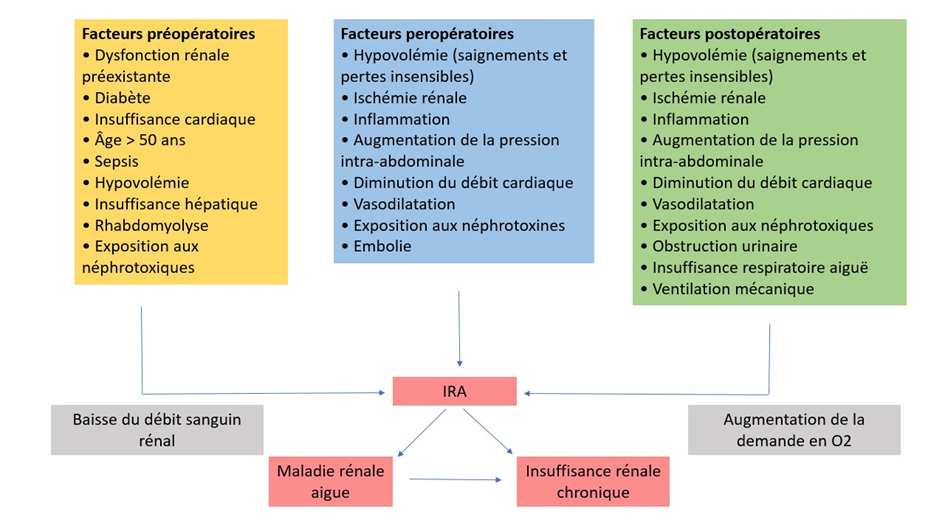
La physiopathologie de l’IRA post-opératoire est complexe et fait intervenir de nombreux facteurs durant les périodes pré-, per- et postopératoire (Figure 1 – d’après 4).
L’IRA est fortement associée à un risque accru de maladie rénale chronique, d’évènements cardiovasculaires et à une surmortalité 3,6,7.
Incidence et facteurs de risque d’IRA post-opératoire
L’incidence de l’IRA en période péri-opératoire est largement dépendante de l’association des facteurs de risque (Tableaux 2 et 3). Elle concerne environ 15 % des patients hospitalisés et varie de 1 % en chirurgie majeure non cardiaque à presque 50 % en chirurgie cardiaque. Son incidence est d’environ 20 % chez les patients pris en charge en réanimation en post-opératoire, dont 9 % nécessiteront la mise sous épuration extra-rénale3.
L’identification des patients à haut risque est un enjeu important de la prise en charge péri-opératoire, afin de permettre la mise en place de stratégies de protection rénale tout au long de la prise en charge. La plupart des patients présentant une IRA en contexte post-opératoire cumulent plusieurs de ces facteurs de risque.
Tableau 2- Principaux facteurs de risque d’IRA liés au terrain et aux procédures chez les patients hospitalisés – d’après 5
| Terrain/Pathologies sous-jacentes | Procédures/contextes |
| Age ≥ 65 ans * Insuffisance rénale chronique (IRC)* Sexe masculin | Sepsis* Instabilité hémodynamique* Période périopératoire* Chirurgie majeure* (en urgence, abdominopelvienne, cardiovasculaire, thoracique, hémorragique) |
| Race noire Obésité (IMC > 40 kg/m2) Hypertension artérielle | Brûlures étendues Traumatismes graves Agents néphrotoxiques (Tableau 3) |
| Insuffisance cardiaque congestive | |
| Insuffisance hépatocellulaire Insuffisance respiratoire sévère | |
| Diabète | |
| Cancer | |
| Anémie |
* : facteurs de risque les plus importants.
IMC : Indice de Masse Corporel ; IRC : Insuffisance Rénale Chronique
Tableau 3- Principaux agents responsables d’IRA en réanimation et en période péri-opératoire – d’après 5
| Produits de contraste iodés |
| Anti-inflammatoires non stéroïdiens |
| Aminosides |
| Amphotéricine Vancomycine |
| ß-lactamines (néphropathies interstitielles) |
| Sulfamides |
| Aciclovir, Méthotrexate, Sels de platine |
| Ciclosporine, Tacrolimus |
Les inhibiteurs du système rénine-angiotensine-aldostérone (SRAA), inhibiteurs de l’enzyme de conversion (IEC) ou inhibiteurs des récepteurs de l’angiotensine 2 (ARA2), ont longtemps été considérés comme des médicaments associés à un risque d’IRA en post-opératoire. Il est actuellement encore recommandé de les interrompre au moins 24 h avant une chirurgie non urgente, si l’indication est une hypertension artérielle 4,5. Cependant, un essai randomisé contrôlé récent, publié après ces recommandations, ne retrouvait pas de différence entre une stratégie d’arrêt ou de poursuite des inhibiteurs du SRAA 8.
De même, les diurétiques ne sont pas des médicaments néphrotoxiques en dehors des situations d’hypovolémie, dans lesquelles ils ne sont pas indiqués. Il est logique de les suspendre au moins le jour de la chirurgie en cas de chirurgie majeure, associée à des pertes hydrosodées importantes. Les diurétiques peuvent avoir un effet néphroprotecteur et sont recommandés, y compris en cas d’IRA quelle que soit sa sévérité, en cas de surcharge hydrosodée 4,9–11.
En raison de leur néphrotoxicité, les solutés de remplissage vasculaire à base d’hydroxyéthylamidon ont été retirés du marché en 2022.
Choix d’un score et détail des principaux déterminants
Le score Acute Kidney Injury Risk Index permet la prédiction de l’IRA en post-opératoire de chirurgie majeure non cardiaque 12. La présence de 3 ou plus des critères listés dans le Tableau 4 est prédictive d’un risque élevé d’IRA, et justifie de renforcer les mesures de néphroprotection et de surveillance de la fonction rénale.
Tableau 4- Acute Kidney Injury Risk Index – 12
| Age ≥ 56 ans |
| Sexe masculin |
| Insuffisance cardiaque congestive |
| Ascite |
| Hypertension artérielle |
| Procédure chirurgicale en urgence |
| Chirurgie intrapéritonéale |
| IRC pré-opératoire (créatinine plasmatique pré-opératoire ≥ 106 µmol/L) |
| Diabète (insulinodépendant ou non) |
Méthodes de prévention et de prise en charge
Il n’existe actuellement aucun traitement pharmacologique de prévention ou de traitement de l’IRA recommandé.
Il est donc recommandé de ne pas utiliser de fénoldopam à faible dose, la dopamine, le peptide atrial natriurétique auriculaire, insulin like growth factor-1 (IGF1) humain recombinant, l’érythropoïétine ou le bicarbonate de sodium, le mannitol, pour la prévention ou le traitement de l’IRA 4,5.
La stratégie de prise en charge péri-opératoire de l’IRA (prévention et traitement), repose sur l’éviction des produits et médicaments néphrotoxiques, l’équilibre glycémique et l’optimisation hémodynamique.
La persistance d’une dégradation de la fonction rénale, tout comme celle de la fonction hémodynamique, doit faire rechercher une complication post-opératoire (chirurgicale, septique, thromboembolique).
La dexmédétomidine constitue une piste thérapeutique intéressante en cours d’évaluation.
Médicaments et produits néphrotoxiques (Tableau 3)
Une évaluation rigoureuse des bénéfices attendus d’un agent néphrotoxique doit être systématique avec mise en balance du risque rénal. Aucun agent n’est formellement contre-indiqué s’il apporte un bénéfice certain en regard de la situation considérée5. Néanmoins, le risque augmente en cas d’association de plusieurs agents potentiellement néphrotoxiques. Une étude a notamment démontré que la double ou triple association de diurétiques, des anti-inflammatoires non stéroïdiens avec ou sans inhibiteurs du système rénine-angiotensine augmente significativement le risque d’IRA13,14. Ainsi :
- Une antibioprophylaxie comportant un aminoside ou de la vancomycine doit être réévaluée et une alternative doit être recherchée chez les patients à risque d’IRA.
- Les anti-inflammatoires non stéroïdiens doivent être évités chez les patients à haut risque rénal en période péri-opératoire.
- L’injection de produit de contraste iodé n’est pas contre-indiquée lorsque l’indication d’une TDM injectée est formelle, y compris en cas d’IRA ou d’IRC sévère 15. Il est recommandé de veillez à l’absence d’hypovolémie chez tous les patients bénéficiant d’une injection de produit de contraste iodé et d’effectuer une prophylaxie par expansion volémique par cristalloïdes chez les patients présentant une IRA, en dehors des situations de surcharge hydrosodée 5,15. L’utilisation de la N-acétylcystéine et du bicarbonate de sodium n’est également pas indiquée dans ces situations.
- Une limitation du nombre d’agents néphrotoxiques et une évaluation des interactions médicamenteuses susceptibles d’augmenter l’exposition à ces agents est nécessaire2.
Equilibre glycémique
L’hyperglycémie a clairement été identifiée comme un facteur d’agression rénale aiguë. Un équilibre glycémique péri-opératoire est donc recommandé, visant à maintenir une glycémie < 10 mmol/L, grâce à un protocole d’administration d’insuline par voie sous-cutanée voir intra-veineuse 5,6.
Prise en charge hémodynamique
L’optimisation hémodynamique est un point clé de la prévention et de la prise en charge de l’IRA en contexte péri-opératoire. Tout retard diagnostique et thérapeutique peut être délétère 16.
Une prise en charge basée sur des algorithmes de gestion hémodynamique du débit cardiaque et de la pression artérielle est recommandée 4. La prévention et le traitement de la surcharge hydrosodée sont également un des axes de la néphroprotection péri-opératoire.
Prévention et traitement de l’hypotension artérielle péri-opératoire
Le recours aux vasopresseurs doit être précoce afin d’éviter et de raccourcir les durées d’hypotension artérielle. En effet, l’intensité de l’hypotension artérielle et sa durée en peri-opératoire sont toutes deux associées à la survenue d’une IRA 16. La noradrénaline diluée est actuellement la drogue de première intention5. La cible de pression artérielle fait toujours débat. Les recommandations suggèrent une PAM ≥65 mmHg ou 60-70 mmHg pour la prévention et le traitement de l’IRA 4,5. Toutefois, des données suggèrent que celle-ci doit probablement être individualisée en fonction de la pression artérielle pré-opératoire pour éviter la survenue de dysfonction d’organes en post opératoire (± 10 % de la pression artérielle systolique pré-opératoire) 17. La dobutamine est le médicament de première intention en cas de défaillance cardiaque.
La période post-opératoire est également à haut risque d’hypotension artérielle et, in fine, d’IRA. En effet, si la pression artérielle est étroitement monitorée en per opératoire (les mesures sont espacées de quelques minutes), ce n’est pas le cas en post opératoire, où les mesures peuvent être espacées de plusieurs heures.
Remplissage vasculaire
Les cristalloïdes doivent être préférés aux solutions salines et colloïdes synthétiques. Les cristalloïdes balancés, solutés hypochlorés tels que le Ringer Lactate, le Ringer acétate-gluconate Plasmalyte® ou le Ringer acétate-malate Isofundine®, sont recommandés en première intention comme solutés de remplissage vasculaire 4,5. Les données concernant le risque d’IRA lors de l’utilisation de l’albumine comme soluté de remplissage vasculaire, notamment l’albumine hyper-oncotique (20 % ou 25 %), étaient contradictoires18,19. Des données plus récentes semblent cependant montrer un risque accru d’IRA, y compris en cas d’utilisation d’albumine iso-oncotique (5 %) 20.
Des stratégies restrictives ont été associées à un risque accru d’IRA post-opératoire, et ne sont pas recommandées en dehors de cas particuliers 4,21.
Tout comme l’hypovolémie, le remplissage vasculaire excessif et inutile doit être absolument évité. La surcharge vasculaire est source de congestion rénale, dont le rôle direct dans la genèse ou l’aggravation d’une IRA a été montré 22,23.
Le monitorage du débit cardiaque est recommandé en per-opératoire afin d’évaluer la réponse à chaque épreuve d’expansion volémique dans l’optimisation du volume d’éjection systolique5. La pression veineuse centrale et l’échocardiographie sont des outils utiles pour l’évaluation de la présence ou non d’un état congestif et pour guider le remplissage vasculaire ou la déplétion dans la période post-opératoire.
Seuils transfusionnels
Le recours à la transfusion ne doit pas être excessif. Le seuil de 7-8 g/dL d’hémoglobine doit être retenu. Le stress oxydant lié à la transfusion de globules rouges, ainsi que les modifications vasomotrices liées à la moindre biodisponibilité du NO et la toxicité tubulaire secondaires à l’hémolyse sont des facteurs pourvoyeurs d’atteinte rénale aiguë24–26.
Perspectives
Intérêt de la dexmédétomidine dans la néphroprotection péri-opératoire
La dexmédétomidine est un agoniste sélectif du récepteur alpha-2 présentant des propriétés pharmacologiques variées, notamment sédatives et antalgiques. Ses indications actuelles sont la sédation-analgésie des patients en réanimation.
Ses propriétés sympatholytiques, vasodilatatrices et anti-inflammatoires pourraient être à l’origine de potentiels effets néphroprotecteurs.
Les effets néphroprotecteurs de la dexmédétomidine permettant une réduction de l’incidence de l’IRA ont été observés initialement en chirurgie cardiaque, puis en post-opératoire de chirurgie majeure non cardiaque et en transplantation rénale 27,28.
Ces données doivent cependant être confirmées par un essai de grande ampleur.
Intérêts et utilisation des biomarqueurs
Les biomarqueurs sont une voie de recherche florissante dans le domaine de l’IRA. Ils sont une voie de recherche prometteuse pour comprendre la physiopathologie et les conséquences de l’IRA et, in fine, mieux permettre sa prédiction, son diagnostic précoce, l’identification des différents phénotypes d’IRA et leurs traitements.
L’utilisation des biomarqueurs rénaux a fait l’objet d’un consensus d’experts, avec des recommandations basées cependant le plus souvent sur un niveau de preuve faible ou modéré 29. Leur utilisation est suggérée dans le cadre de la prédiction et de la prévention de l’IRA, pour aider à identifier les patients pouvant bénéficier de stratégies de prévention29. L’utilisation des biomarqueurs est également actuellement suggérée pour améliorer le diagnostic et la compréhension des mécanismes de l’IRA.
Le biomarqueur doit être choisi en fonction du contexte clinique (services d’urgences, de réanimation, contexte péri-opératoire, etc…) et de son rôle. Parmi les principaux biomarqueurs, la cystatine C et la proenképhaline A plasmatiques sont des marqueurs de filtration glomérulaire, tandis que le tissue inhibitor of metalloproteinases-2 (TIMP-2) et l’insulin-like growth factor binding protein 7 (IGFBP-7) urinaires sont des marqueurs de stress tubulaire permettant la prédiction de la sévérité de l’IRA. D’autres biomarqueurs de dommages tubulaires sont utilisés pour la prédiction, le diagnostic et/ou l’évaluation de la sévérité de l’IRA (neutrophil gelatinase-associated lipocalin (NGAL) plasmatique et urinaire, kidney Injury Molecule–1 (KIM-1) urinaire, liver fatty acid-binding protein (L-FABP) plasmatique et urinaire)30.
Références :
1. Kellum, J. A. et al. Work group membership. Kidney Int 2, 1 (2012).
2. Ostermann, M. et al. Controversies in acute kidney injury: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Conference. Kidney Int. 98, 294–309 (2020).
3. Zarbock, A. et al. Epidemiology of surgery associated acute kidney injury (EPIS-AKI): a prospective international observational multi-center clinical study. Intensive Care Med. 49, 1441–1455 (2023).
4. Prowle, J. R. et al. Postoperative acute kidney injury in adult non-cardiac surgery: joint consensus report of the Acute Disease Quality Initiative and PeriOperative Quality Initiative. Nat. Rev. Nephrol. 17, 605–618 (2021).
5. Ichai, C. et al. Insuffisance rénale aiguë en périopératoire et en réanimation (à l’exclusion des techniques d’épuration extrarénale). Anesth. Réanimation 2, 184–205 (2016).
6. O’Connor, M. E., Kirwan, C. J., Pearse, R. M. & Prowle, J. R. Incidence and associations of acute kidney injury after major abdominal surgery. Intensive Care Med. 42, 521–530 (2016).
7. On behalf of the Acute Disease Quality Initiative Workgroup 16. et al. Acute kidney disease and renal recovery: consensus report of the Acute Disease Quality Initiative (ADQI) 16 Workgroup. Nat. Rev. Nephrol. 13, 241–257 (2017).
8. Legrand, M. et al. Continuation vs Discontinuation of Renin-Angiotensin System Inhibitors Before Major Noncardiac Surgery: The Stop-or-Not Randomized Clinical Trial. JAMA 332, 970–978 (2024).
9. Grams, M. E. et al. Fluid Balance, Diuretic Use, and Mortality in Acute Kidney Injury. Clin. J. Am. Soc. Nephrol. 6, 966–973 (2011).
10. Shen, Y., Zhang, W. & Shen, Y. Early diuretic use and mortality in critically ill patients with vasopressor support: a propensity score-matching analysis. Crit. Care 23, 9 (2019).
11. Association between diuretics and successful discontinuation of continuous renal replacement therapy in critically ill patients with acute kidney injury – PubMed. https://pubmed.ncbi.nlm.nih.gov/30305122/.
12. Kheterpal, S. et al. Development and Validation of an Acute Kidney Injury Risk Index for Patients Undergoing General Surgery: Results from a National Data Set. Anesthesiology 110, 505–515 (2009).
13. Lapi, F., Azoulay, L., Yin, H., Nessim, S. J. & Suissa, S. Concurrent use of diuretics, angiotensin converting enzyme inhibitors, and angiotensin receptor blockers with non-steroidal anti-inflammatory drugs and risk of acute kidney injury: nested case-control study. BMJ 346, e8525 (2013).
14. Rivosecchi, R. M. et al. Drug Class Combination–Associated Acute Kidney Injury. Ann. Pharmacother. 50, 953–972 (2016).
15. Davenport, M. S. et al. Use of Intravenous Iodinated Contrast Media in Patients with Kidney Disease: Consensus Statements from the American College of Radiology and the National Kidney Foundation. Radiology (2020) doi:10.1148/radiol.2019192094.
16. Walsh, M. et al. Relationship between intraoperative mean arterial pressure and clinical outcomes after noncardiac surgery: toward an empirical definition of hypotension. Anesthesiology 119, 507–515 (2013).
17. Futier, E. et al. Effect of Individualized vs Standard Blood Pressure Management Strategies on Postoperative Organ Dysfunction Among High-Risk Patients Undergoing Major Surgery: A Randomized Clinical Trial. JAMA 318, 1346–1357 (2017).
18. Wiedermann, C. J., Dunzendorfer, S., Gaioni, L. U., Zaraca, F. & Joannidis, M. Hyperoncotic colloids and acute kidney injury: a meta-analysis of randomized trials. Crit. Care 14, R191 (2010).
19. Schortgen, F., Girou, E., Deye, N., Brochard, L., & CRYCO Study Group. The risk associated with hyperoncotic colloids in patients with shock. Intensive Care Med. 34, 2157–2168 (2008).
20. Lazzareschi, D. V. et al. Intraoperative Use of Albumin in Major Noncardiac Surgery: Incidence, Variability, and Association With Outcomes. Ann. Surg. 278, e745–e753 (2023).
21. Myles, P. S. et al. Restrictive versus Liberal Fluid Therapy for Major Abdominal Surgery. N. Engl. J. Med. (2018) doi:10.1056/NEJMoa1801601.
22. Lopez, M. G. et al. Intraoperative venous congestion and acute kidney injury in cardiac surgery: an observational cohort study. Br. J. Anaesth. 126, 599–607 (2021).
23. Beaubien-Souligny, W. et al. Alterations in Portal Vein Flow and Intrarenal Venous Flow Are Associated With Acute Kidney Injury After Cardiac Surgery: A Prospective Observational Cohort Study. J. Am. Heart Assoc. 7, e009961 (2018).
24. Kanias, T. & Gladwin, M. T. Nitric oxide, hemolysis, and the red blood cell storage lesion: interactions between transfusion, donor, and recipient. Transfusion (Paris) 52, 1388–1392 (2012).
25. Karkouti, K. Transfusion and risk of acute kidney injury in cardiac surgery. Br. J. Anaesth. 109, i29–i38 (2012).
26. Van Avondt, K., Nur, E. & Zeerleder, S. Mechanisms of haemolysis-induced kidney injury. Nat. Rev. Nephrol. 15, 671–692 (2019).
27. Douville, N. J. et al. Perioperative Acute Kidney Injury: Diagnosis, Prediction, Prevention, and Treatment. Anesthesiology 142, 180–201 (2025).
28. Zhuang, K. et al. Dexmedetomidine and acute kidney injury after non-cardiac surgery: A meta-analysis with trial sequential analysis. Anaesth. Crit. Care Pain Med. 43, 101359 (2024).
29. Ostermann, M. et al. Recommendations on Acute Kidney Injury Biomarkers From the Acute Disease Quality Initiative Consensus Conference: A Consensus Statement. JAMA Netw. Open 3, e2019209 (2020).
30. Ostermann, M. et al. Biomarkers in acute kidney injury. Ann. Intensive Care 14, 145 (2024).

















